O que é uma reação química?
É uma transformação onde há formação de novas substâncias.
Reação química = Transformação química
↓
Reagentes = Produtos da Reação
Substâncias iniciais Substâncias finais
Formas de detetar uma reação química:
- Libertação de gases
- Desaparecimento de um sólido (sem ser por dissolução)
- Formação de um sólido
- Alteração de cor
- Aparecimento de um cheiro.
Carácter químico de uma solução:
- Solução Ácida (pH inferior a 7)
- Solução Básica ou Alcalina (pH superior a 7)
- Solução Neutra (pH de 7)
Azul de Tornesol:
A tintura de Tornesol fica vermelha na presença de soluções ácidas.
A tintura de Tornesol torna-se arroxeada na presença de soluções neutras.
A tintura de Tornesol não sofre alterações de cor na presença de soluções básicas.
Fenolftaleína:
A fenolftaleína não sofre alterações de cor na presença de soluções ácidas ou neutras.
A fenolftaleína fica carmim na presença de soluções básicas.
Constituição da matéria:
As moléculas de qualquer substância atraem-se uma às outras.
No estado sólido elas encontram-se próximas e forma ligações entre si. Mas quando se fornece energia (aquecendo) essas ligações podem quebrar-se, as moléculas afastam-se e a substância passa ao estado líquido. Neste caso as moléculas ficam afastadas e formam menos ligações entre si. E se mais energia for fornecida mais ligações são desfeitas e mais moléculas se afastam, deixando eventualmente de estar ligadas entre si e passando mesmo ao estado gasoso.
No estado sólido elas encontram-se próximas e forma ligações entre si. Mas quando se fornece energia (aquecendo) essas ligações podem quebrar-se, as moléculas afastam-se e a substância passa ao estado líquido. Neste caso as moléculas ficam afastadas e formam menos ligações entre si. E se mais energia for fornecida mais ligações são desfeitas e mais moléculas se afastam, deixando eventualmente de estar ligadas entre si e passando mesmo ao estado gasoso.
Características
Estados
|
Espaços
vazios entre os cropusculos
|
Movimento
dos cropusculos
|
Força
entre os cropusculos
|
Organização
dos cropusculo.
|
Sólido
|
Muito Pouco
|
Muito Pouco
|
Muito Fortes
|
Grande
|
Líquido
|
Pouco
|
Pouco
|
Fortes
|
Pouca
|
Gasoso
|
Muito
|
Muito
|
Fracas
|
Muito Pouca
|
cas
Átomo = Particula elementar constituinte por toda a matéria
↓
Protão: Carga elétrica positiva (núcleo)
Eletrão: Carga elétrica negativa (nuvem eletrónica)
Neutrão: Carga elétrica neutra (núcleo)
Os estados físicos da matéria:

- Sólido + Líquido = Fusão
- Líquido + Gasoso = Vaporização
- Gasoso + Sólido = Sublimação
- Líquido + Sólido = Solidificação
- Gasoso + Líquido = Condensação
Ponto de fusão
↓
Temperatura à qual ocorre a fusão de uma substância ou seja a passagem do estado sólido ao líquido.
Ponto de ebulição
↓
Temperatura à qual ocorre a ebulição, ou seja, a passagem do estado líquido ao gasoso.


Reações de combustível:
É uma reação química entre um combustível (substância que arde) e um comburente (substância que permite o combustível arder), sendo ainda necessário uma fonte de indignição para ativar a reação.
Exemplos de combustíveis: Carvão, madeiras
Álcool Etílico, gasolina
Butano, metano.
Exemplos de comburentes: Oxigénio, Cloro
Fontes de ignição: Chama viva, faisca
Formação de estalactites e estalagmites:
Quando chove a água retém o dióxido existente na atmosfera formando um ácido muito fraco chamado o ácido carbónico.
Acontece que as rochas calcarias têm micro fendas entre elas por onde a água entra e como sendo um ácido dissolve o calcário abrindo cada vez mais essas tais fendas e passados milhões de anos essas fendas aumentam formando grutas.
Para formar as estalactites e as estalagmites é preciso a água entrar dentro dessas mesmas grutas. Acontece que dentro das grutas as condições dão diferentes e o calcário precepita depositando-se no teto das grutas.
O mesmo acontece para as estalagmites mas o calcário em vez de precepitar no teto, precepita-se no chão, por vezes é possível as estalcites encontrarem-se com as estalagmites formando uma coluna.

Fórmulas Químicas:
Os átomos ligam-se quimicamente entre si e formam Moléculas.
Moléculas elementares: Moléculas constituintes por átomos do mesmo elemento químico.
Moléculas compostas: Moléculas constituintes por átomos de diferentes elementos químicos.
 Exemplo: NH3 = Amoníaco, 2 moléculas de amoníaco = 2NH3
Exemplo: NH3 = Amoníaco, 2 moléculas de amoníaco = 2NH3
2 Átomos de Oxigénio = 2O
2 Moléculas de Oxigénio = 2O2
1 Molécula de Oxigénio = O2
Substâncias iónicas: Substâncias constituidas por iões positivos e negativos.
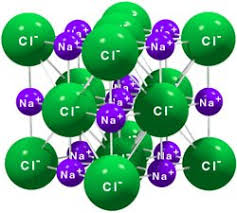
Fórmula química: NaCl = Cloreto de sódio (sal de cozinha)
Não tem cargas elétricas dos iões; composto iónico é neutro.
Na: Ião positivo
Cl: Ião negativo
Ião positivo= Catião
Ião negativo= Anião
Iões: São partículas em carga elétrica que derivam de um átomo ou de um conjunto de átomos (molécula) por perda de uma eletrão (iões)

Catalisadores:
↓
Catalisadores biológicos ou enzimas:
↓
São substâncias que existem nos seres vivos e que são específicas (ou seja cada enzima tem a sua função).
Algumas substâncias que permitem conservar os alimentos:
- Sal.
- Óleo ou azeite.
- Açúcar (compotas ou caldos).
- Vinagre.
- Foneiro (enchidos, carne, presunto, salmão...).
- Retirar o ar das embalagens (vacuo).
- Retirar a água (desidratação).
Substância iónicas => Constituídas por iões
↓
Positivos: Défice de eletrão -> Catiões
Negativos: Excesso de eletrões -> Aniões
Manifestações de energia:
↓
Energia potencial química: Associada aos alimentos
Associada aos combustíveis
Associada às pilhas
Energia potencial elástica: Associada aos materiais elásticos e moles
hmáx: Altura máxima
hmin: Altura mínima
Energia cinética (Ec): Associada ao movimento dos corpos
m: massa do corpo (kg)
v: velocidade do corpo (m/s)
Pilha -------------------> Fios elétricos ------------------> Lâmpada
↓
Energia potencial -----------------> Energia elétrica -----------> Energia luminosa
química Energia térmica
Energia luminosa: Energia útil (utilizada para o fim que se destina)
Energia térmica: Energia dissipada (não utilizada para o fim pretendido)

Calor: Transferência de energia térmica, assim o calor é a medida de energia térmica transferida entre corpos a temperaturas diferentes.
Temperatura: É uma grandeza física, que se relaciona com o grau de agitação dessas partículas, ou seja, com a energia cinética média das partículas.
↓
Mede-se com termómetros, a unidade no S.I é Kelvin (K)
mas é mais utilizado os Graus Celsius (ºC)
Duas temperaturas ficaram iguais
↓
Equilíbrio térmico
Ondas: É a propagação de uma perturbação num meio natural ou não.
Uma onda transporta energia e não matéria.
Classificação de ondas:


Formação de estalactites e estalagmites:
Quando chove a água retém o dióxido existente na atmosfera formando um ácido muito fraco chamado o ácido carbónico.
Acontece que as rochas calcarias têm micro fendas entre elas por onde a água entra e como sendo um ácido dissolve o calcário abrindo cada vez mais essas tais fendas e passados milhões de anos essas fendas aumentam formando grutas.
Para formar as estalactites e as estalagmites é preciso a água entrar dentro dessas mesmas grutas. Acontece que dentro das grutas as condições dão diferentes e o calcário precepita depositando-se no teto das grutas.
O mesmo acontece para as estalagmites mas o calcário em vez de precepitar no teto, precepita-se no chão, por vezes é possível as estalcites encontrarem-se com as estalagmites formando uma coluna.
Fórmulas Químicas:
Nome do elemento químico
|
Símbolo
químico
|
Hidrogénio
|
H
|
Potássio
|
K
|
Oxigénio
|
O
|
Hélio
|
He
|
Cálcio
|
Ca
|
Cobre
|
Cu
|
Enxofre
|
S
|
Os átomos ligam-se quimicamente entre si e formam Moléculas.
Nome
das moléculas
|
|
Hidrogénio
|
H2= 2 átomos de
Hidrogénio ligados entre si
|
Oxigénio
|
O2= 2 átomos de oxigénio ligados entre si
|
Azoto
|
N2= 2 átomos de azoto ligados entre si
|
Água
|
H2O= 2 átomos de
hidrogénio e 1 de oxigénio
|
Dióxido de carbono
|
CO2= 1
átomo de carbono e 2 de oxigénio
|
Monóxido de carbono
|
Moléculas elementares: Moléculas constituintes por átomos do mesmo elemento químico.
Moléculas compostas: Moléculas constituintes por átomos de diferentes elementos químicos.
2 Átomos de Oxigénio = 2O
2 Moléculas de Oxigénio = 2O2
1 Molécula de Oxigénio = O2
Substâncias iónicas: Substâncias constituidas por iões positivos e negativos.
Fórmula química: NaCl = Cloreto de sódio (sal de cozinha)
Não tem cargas elétricas dos iões; composto iónico é neutro.
Na: Ião positivo
Cl: Ião negativo
Ião positivo= Catião
Ião negativo= Anião
Iões: São partículas em carga elétrica que derivam de um átomo ou de um conjunto de átomos (molécula) por perda de uma eletrão (iões)
NaCL - cloreto de sódio
Composto iónico: substâncias constituídas por iões positivos e iões negativos
Na (átomo de sódio) --------1é -------- Na------ião psoitivo ou catião
11 protões = 11 electrões 11 protões não é igual a 10 electrões
+11-11 = neutro 11-10 = +1
CL (átomo de cloro) ------- +1é-------CL-------ião negativo ou anião
17 protões = 17 electrões 17 protões não é igual a 18 electrões
+17-18 = -1
Catalisadores:
↓
São substâncias que interferem na velocidade da reação química, mas que não são consumidas.
Catalisadores positivos -> Aceleram a reação química com mais velocidade.
Catalisadores negativos ou inibidores -> Retardam a reação química com menos velocidade.
Catalisadores biológicos ou enzimas:
↓
São substâncias que existem nos seres vivos e que são específicas (ou seja cada enzima tem a sua função).
Algumas substâncias que permitem conservar os alimentos:
- Sal.
- Óleo ou azeite.
- Açúcar (compotas ou caldos).
- Vinagre.
- Foneiro (enchidos, carne, presunto, salmão...).
- Retirar o ar das embalagens (vacuo).
- Retirar a água (desidratação).
Substância iónicas => Constituídas por iões
↓
Positivos: Défice de eletrão -> Catiões
Negativos: Excesso de eletrões -> Aniões
Manifestações de energia:
- Energia radiante
- Energia térmica
- Energia solar
- Energia nuclear
- Energia dos combustíveis
- Energia eólica
- Energia hídrica
- Energia das mares
- Energia cinética
- Energia elástica
- Energia potencial gravítica
- Energia sonora
- Energia geotérmica
- Energia luminosa
As duas formas fundamentais de energia:
Energia potencial => energia armazenada por corpos e que pode vir a ser utilizada
↓
Energia potencial química: Associada aos alimentos
Associada aos combustíveis
Associada às pilhas
Energia potencial elástica: Associada aos materiais elásticos e moles
hmáx: Altura máxima
hmin: Altura mínima
Energia cinética (Ec): Associada ao movimento dos corpos
m: massa do corpo (kg)
v: velocidade do corpo (m/s)
Pilha -------------------> Fios elétricos ------------------> Lâmpada
Energia potencial -----------------> Energia elétrica -----------> Energia luminosa
química Energia térmica
Energia luminosa: Energia útil (utilizada para o fim que se destina)
Energia térmica: Energia dissipada (não utilizada para o fim pretendido)
Temperatura: É uma grandeza física, que se relaciona com o grau de agitação dessas partículas, ou seja, com a energia cinética média das partículas.
↓
Mede-se com termómetros, a unidade no S.I é Kelvin (K)
mas é mais utilizado os Graus Celsius (ºC)
Duas temperaturas ficaram iguais
↓
Equilíbrio térmico
Ondas: É a propagação de uma perturbação num meio natural ou não.
Uma onda transporta energia e não matéria.
Classificação de ondas:
- Quanto à sua natureza.
Ondas mecânicas:
- Ondas que se propagam num meio natural
Ondas eletromagnéticas:
- Ondas que não precisam de um meio material para se propagarem, propagam-se no vazio (ou no vácuo).
Ondas longitudinais:
- A direção da perturbação é igual à propagação da onda.
Ondas transversais:
- A direção da perturbação é perpendicular à direção da onda.
Existem vários tipos de ondas:
- Onda periódica
- Onda não periódica
